







こちらのページでは電池のしくみについて解説していきます。
イラストや図を用いてわかりやすく解説していくので授業の予習復習や定期テスト対策にご活用ください!
その他のやる気アシストの勉強記事 (理科編) もこちらから見ることができます。ぜひご覧ください!
電池をつくるには、電解質と異なる2つの金属板が必要になります。なぜ必要なのか、電池のしくみを見ていきましょう。
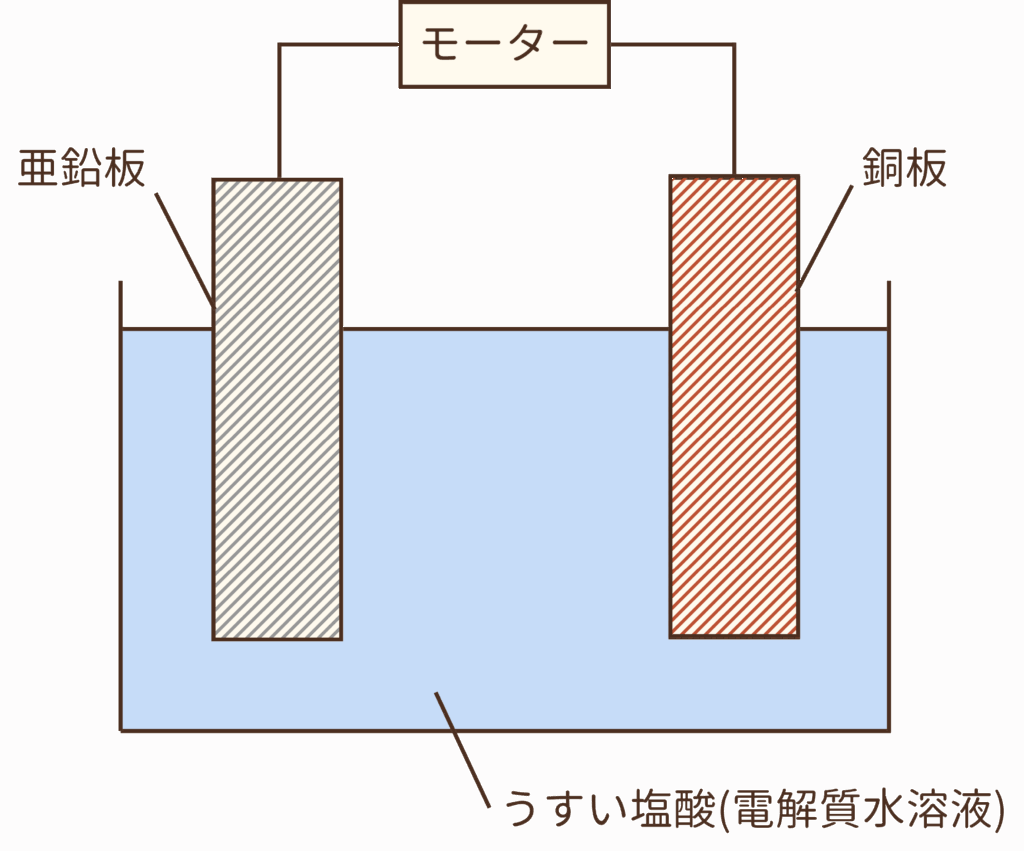
ビーカーの中にうすい塩酸を入れ、亜鉛板と銅板を入れて導線でつなぎます。導線にモーターをつなぐと、モーターが動きます。つまり、この図このものが原始的な電池のかたちなのです。
なぜ電流が流れるの?
なぜモーターは動き電流が流れるのか、それは亜鉛板・銅板・塩酸のあいだで化学変化が起こり、電子が移動しているからなんです。
この図の場合は、亜鉛板が-極・銅板が+極となります。
異なる2枚の金属板が必要なのは、金属板が電池の+極、-極になるためのものだからなのです。
では、この装置のなかでどのような化学変化がおきているのかを詳しく見ていきましょう。
02.
金属は、電解質水溶液に入れるとイオンになります。(金属の種類によって、イオンになりやすいものとなりにくいものがあります。)
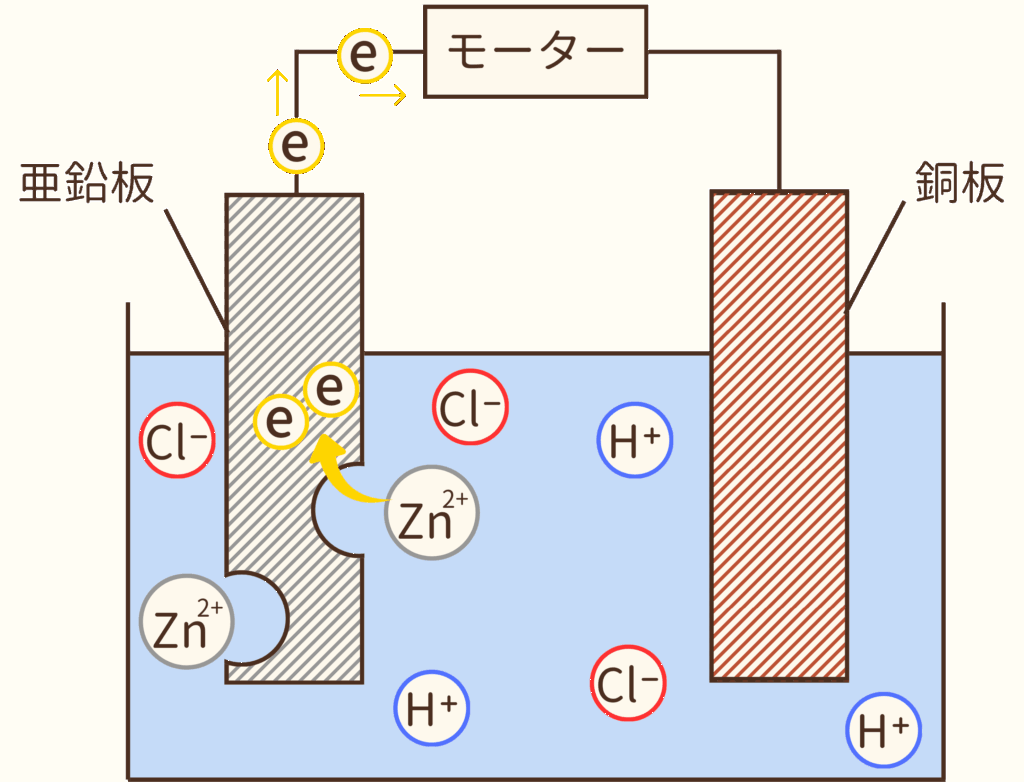
亜鉛はイオンになりやすい金属であるため、塩酸の中に入れると溶けだし亜鉛イオン(Zn²⁺)になります。
Zn²⁺ということは、電子(e)を2つ手放した陽イオンであるということです(Zn→Zn²⁺ + 2e⁻)。手放した電子(e)は、導線をたどり銅板へと向かいます。
03.
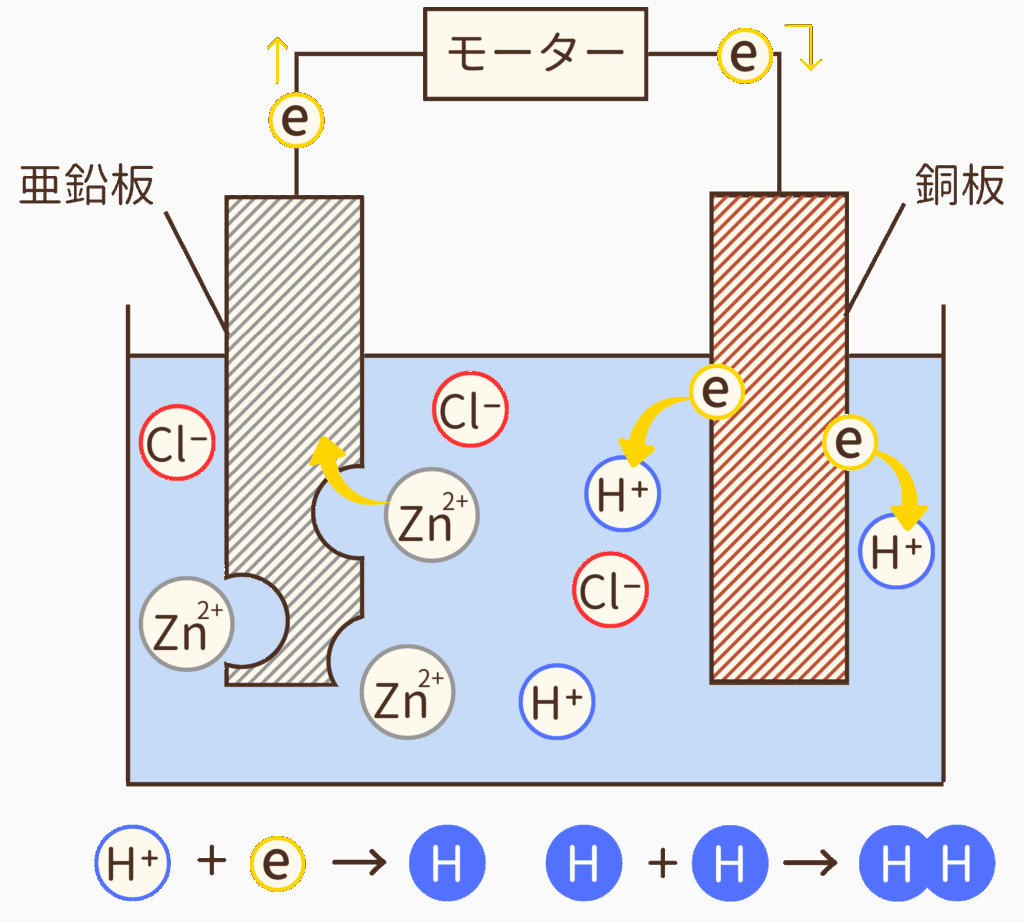
銅板へたどり着いた電子(e)は、銅板から塩酸の水溶液に放たれます。そして、近くの水素イオン(H⁺)と結びつき(H⁺ + e⁻ → H)、水素原子は2つあわさりH₂(水素)になります。
04.
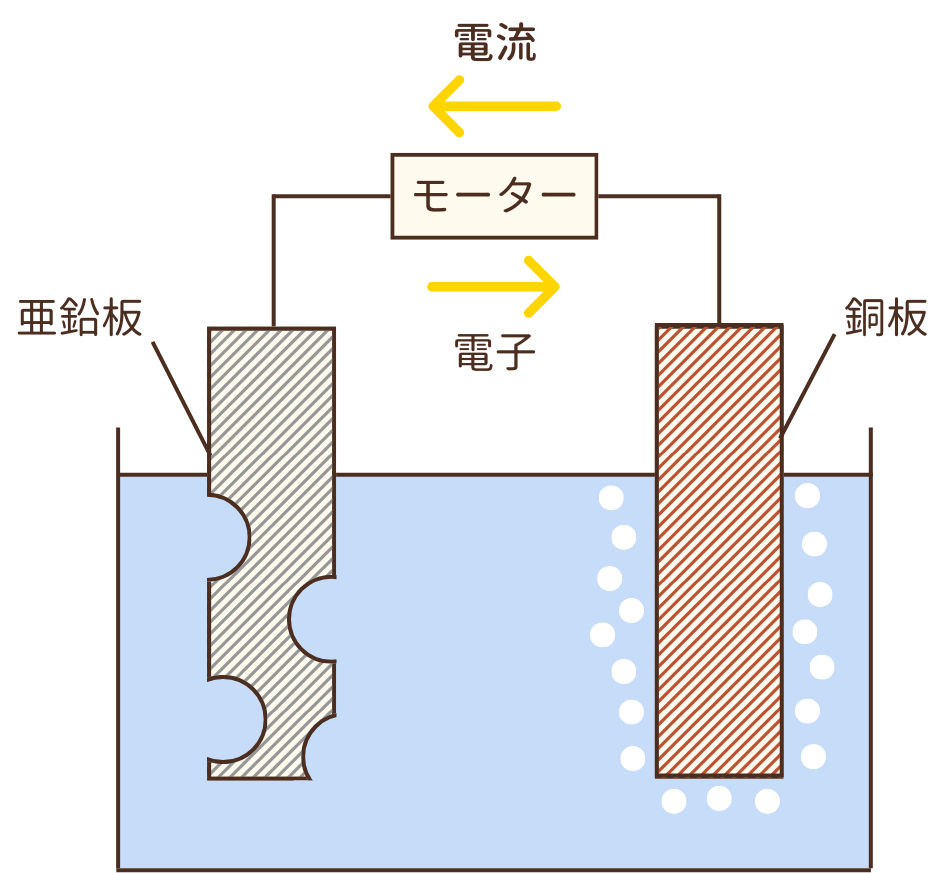
結果として、亜鉛板は化学反応が起こるにつれボロボロになり、銅板の周りには気体(水素)が発生して気泡が現れます。
また、電子が亜鉛板から銅板へと移動するため、電流は銅板から亜鉛板へと流れます。(電流は電子の動きと逆の向きに流れます。)
先ほどの説明(02.)のなかで、金属の種類によってイオンになりやすいものとなりにくいものがある・亜鉛はイオンになりやすい金属であるという記載がありましたが、このイオンになりやすい金属の順番というのは決まっており、イオン化傾向と呼べれています。
イオン化傾向を覚えよう

電池をつくるときに必要な2つの金属板は、イオン化傾向が大きいものと小さいものである必要があります。
\小・中・高校生の勉強にお悩みのある方へ/

一次電池
_ 一回使い切り電池 ex. ボルタ電池、マンガン電池、アルカリマンガン電池
二次電池
_ 充電して何度も使える電池 ex. 鉛蓄電池、リチウムイオン電池、ニッケル水素電池
燃料電池
_ 燃料の化学変化から電気エネルギーを取り出す電池 ex. 水素燃料電池、メタノール燃料電池
最後までお読みいただきありがとうございました。
今回は電気分解について紹介しました。その他の理科の定期テスト対策の記事はこちらからチェックしてみてください!
他にも様々なお役立ち情報をご紹介しているので、ぜひご参考にしてください。質問などございましたら、お気軽にお問い合わせください!







