






水溶液と一口に言っても、溶質や溶媒の違いもありますし、同じ溶質や溶媒であっても、溶媒に溶けている溶質の割合によってその濃度が変わります。
今回は溶液の濃さである濃度に着目して、水溶液の単元で出てくる用語について解説して、実際に計算まで行っていきたいと思います!
いきなりだと分かり辛いと思うので、最初に「溶液・溶媒・溶質」の簡単な説明をしていきます。
具体性があると分かりやすいので砂糖水を例にしてみていきます。
溶液:水溶液そのものの事。「溶質+溶媒」です。例で言うと砂糖水そのものです。
溶媒:溶質を溶かしている液体の事。例で言うと水ですね。
溶質:溶けているものの事。例で言うと砂糖です。
これからの文章が分かり辛いなって方は
溶液=砂糖水、溶媒=水、溶質=砂糖
と、読み替えると理解がしやすいと思います。
濃度を示す指標として質量パーセント濃度があります。これは、溶液100g中に溶質がどれだけ溶けているかを示すものです。
式で表すと、
質量パーセント濃度=溶質÷溶液×100
となります!後ろに100を掛けているのは、出てきた値を百分率で表したいからです。なので、出てきた値に必ず%をつけましょう!
また、溶液は溶質と溶媒の量はを合わせた量に等しいので、
質量パーセント濃度=溶質÷(溶質+溶媒)×100
と表すことも出来ます。
では、この指標を用いて問題を解いていきましょう!
”水180gと砂糖20gを混ぜてできた水溶液がある。この質量パーセント濃度を求めてみよう。”
質量パーセント濃度を求めるためには、それを求めるための式に含まれている”溶質”と”溶媒”の量が分かっていれば解くことが出来ます!
その量は溶媒180gと溶質20gであるとわかっているので、これを上で示した質量パーセント濃度の式に当てはめてみると、
20÷(180+20)×100=20÷200×100=10
となり、この水溶液の濃度は10%と分かります。
単純な式なので、意外と簡単に解けたのではないでしょうか。
”濃度が5%の水溶液を作りたい。溶質を5g使って作るとき、溶媒は何g必要なのか求めてみよう。”
この問題は、質量パーセント濃度と溶質の量が決まっていて、溶媒の量が分からないという問題です。
これも、質量パーセント濃度の式を使えば簡単に解くことができます!
溶媒の量をsグラムとして、上の式に質量パーセント濃度と溶媒、溶質を代入すると、
5÷(5+s)×100=5
となります。この式の形を見て「意味が分からない!」と思った人は、最初に説明した質量パーセント濃度の式と見比べてみて下さい。
さて、これをs=の形に持っていきます。(数学みたいになってしまいましたが、理科はこういった計算がよくあるので、できるようにしておきましょう!)
5×100=5×(5+s)
100=5+s
s=95
となり、溶媒は95g必要であるということが分かりました!
こういう問題で、「質量パーセント濃度の値と溶質の値が同じだから、溶媒は100gだ!」と計算せずに答えて間違えてしまうというパターンが結構聞かれます。ここで100gとなるのは”溶媒”ではなくて”溶液”の量なので、気を付けてください!
(逆に言えば、溶液が100gだとわかれば、そこから溶質5gを引くと溶媒95gを導くことが出来ます。計算した後に確かめなどで活用できるかもしれません。)
溶媒が100gあるときに、溶質がどれだけ溶けるかを表した指標もあります。それを溶解度といいます。
溶解度は溶媒が何であるか、温度がどれくらいかによって決まった値を持っています。
溶解度と質量パーセント濃度が一緒だと思ってこんがらがってしまう方がたまにいるので、全然違うということを理解してくださいね!
では、これが使われている問題を解いてみましょう!
”40℃の水100gにミョウバンを16g溶かしてある。これに10g追加すると、殆ど溶けたが、一部は溶けなかった。水に溶けなかったミョウバンは何グラムか求めてみよう。”
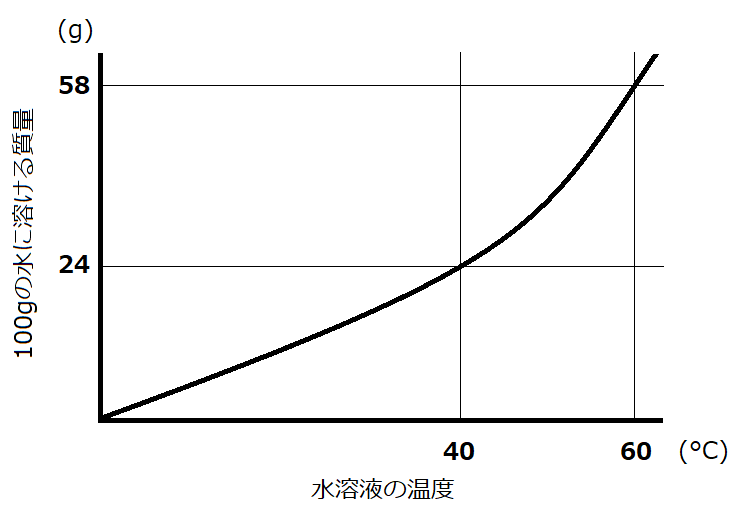
この問題はミョウバンが100gの水40℃にどれくらい溶けるのか知ることで解くことが出来ます。その時に、問題文で「△℃の水100gにミョウバンは■g溶ける」と書いてあればわかりやすいかと思いますが、そういう場合は少なくて、大体の問題は上に挙げたような曲線が示されます。
これを溶解度曲線といい、100gの水が△℃の時にどれだけ物質が溶けるのかを表したグラフです(物質によって溶解度曲線は異なります)。
見方は至って簡単です!この曲線よりも下側の部分が溶ける物質の量で、上側の部分は飽和して解けない量となります。
例えば、今回の問題では40℃の水100gの時のミョウバンの溶解度が知りたいですね。40℃と書いてあるところから上に線を伸ばして、曲線と突き当たったところで左軸に書かれた数字を読むと、24(g)と書いてあります。
ということは、100gの水に対して24gのミョウバンが溶けるということです!
さて、問題に戻ると、
元々16gのミョウバンが溶けていて、そこに10gを追加するということでした。これを足すと、16+10=26(g)となります。
ところで、この温度での溶解度は24gなので、
26-24=2(g)
より、2gだけ溶けずに残ってしまう、ということが分かります!
\小・中・高校生の勉強にお悩みのある方へ/
”60℃の水100gに丁度飽和するだけミョウバンを入れた。これを40℃に冷やすと、ミョウバンは何グラム析出するか求めてみよう。”
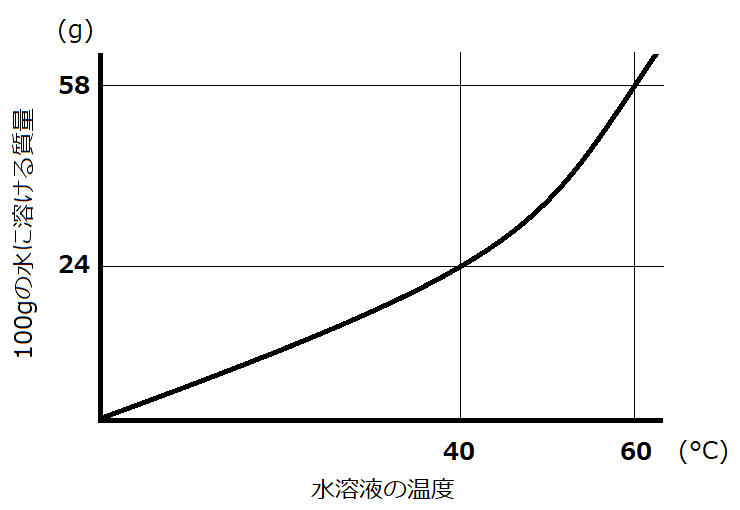
今度はミョウバンが飽和するだけ水に入っているという問題です。飽和というのは「溶解度ギリギリまで溶かしてある状態」なので、すなわち溶解度曲線に突き当たっているところの量が溶質の量である、ということです。
では、溶解度曲線を見てみましょう。
溶解度曲線より、60℃の水100gの溶解度は58gとなっているので、この問題の溶液には58gの溶質が入っていることが分かりました!
さて、この溶液を40℃まで下げていくと、溶解度は24gと小さくなるので、24gを超えた分は析出して出てきてしまいます。
これを計算すると、
[元々の溶質の量]-[40℃で溶ける溶質の量]=58-24=34(g)
となります。
したがって、34g析出する、が正解です!
水溶液の濃度はテストでとても出やすい問題です。高校受験で出題されることもよくあるので、「溶液」「溶質」「溶媒」「質量パーセント濃度」「溶解度」の5つはすべてしっかり説明できる位に理解してみてくださいね!



