今回は「化学反応式」について学んでいきます。
化学反応式を学ぶために必要な知識である原子・分子の内容は覚えているでしょうか。
その他の理科の勉強記事もこちらから見ることができます。ぜひご覧ください!
それではさっそく見ていきましょう!


私たちにとって身近な存在である10円硬貨。綺麗なものもあれば汚れたものもありますよね。10円硬貨が汚れる原因の1つにこれから解説していく酸化という化学反応が関係しています。
どういうことか、詳しく見ていきましょう。
化学反応によって、2種類以上の元素が結合することで生成する物質のことを 化合物 といいます。
化学変化のうち、酸素と結びつく場合を特に 酸化 といい、これによってできる化合物を 酸化物 といいます。
冒頭の10円硬貨が汚れるのは錆(さび)なのでは?と思った方もいるかもしれません。実は、錆とは金属がゆっくり酸化した状態を指しています。 金属の酸化は長時間空気に触れることで自然に起こりますが、加熱することで短時間で酸化させることもできるため、酸化の実験では物質を加熱することが多いです。
今回は酸化のなかでも鉄と銅の酸化について詳しく紹介していきます。
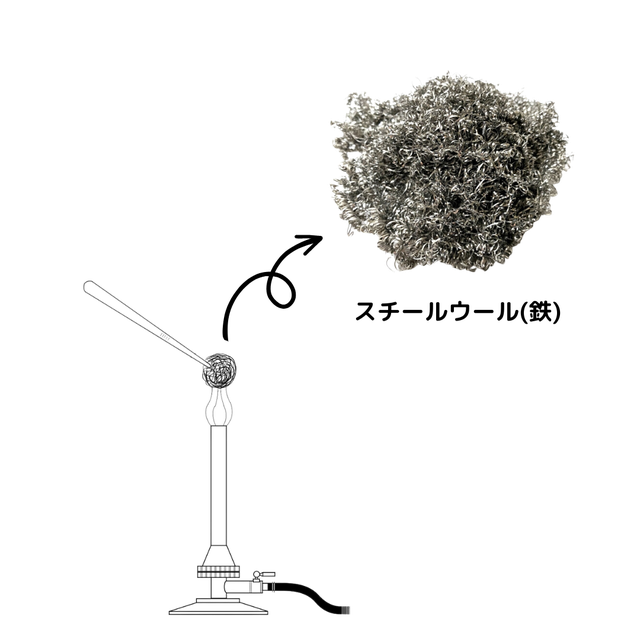
スチールウール(鉄)を加熱すると酸化が起こり、酸化鉄が生成されます。酸化鉄は反応前の鉄に比べて光沢がなく、もろく、加熱前に比べて質量が大きくなります。(質量が大きくなるのは結びついた酸素の質量が追加されるからです。)さらに、酸化前のスチールウールを塩酸に入れると水素が発生するのに対し、酸化鉄は塩酸に入れても何も起こらないなどの変化もあります。
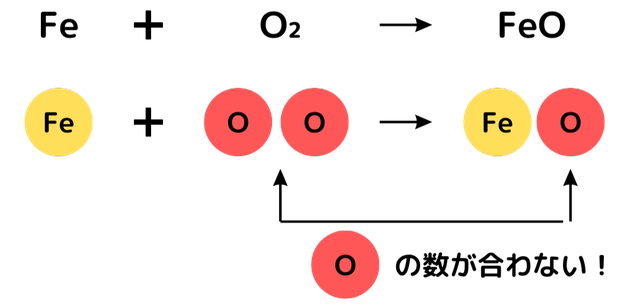
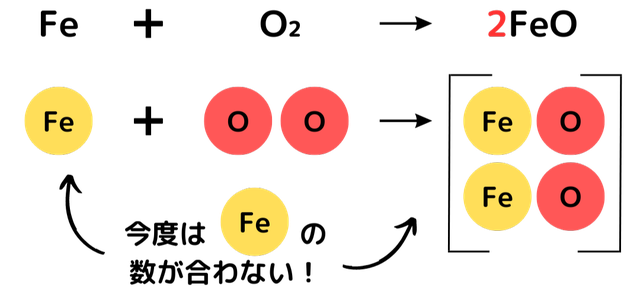
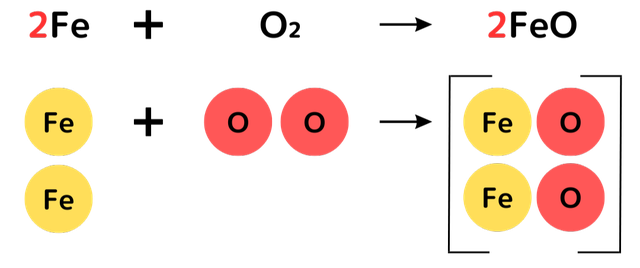
鉄の酸化を化学式で表すと、次のようになります。
2Fe + O₂ → 2FeO
鉄 + 酸素 → 酸化鉄
FeとFeOの前に数字がありますね。下の図で詳しく解説しています。
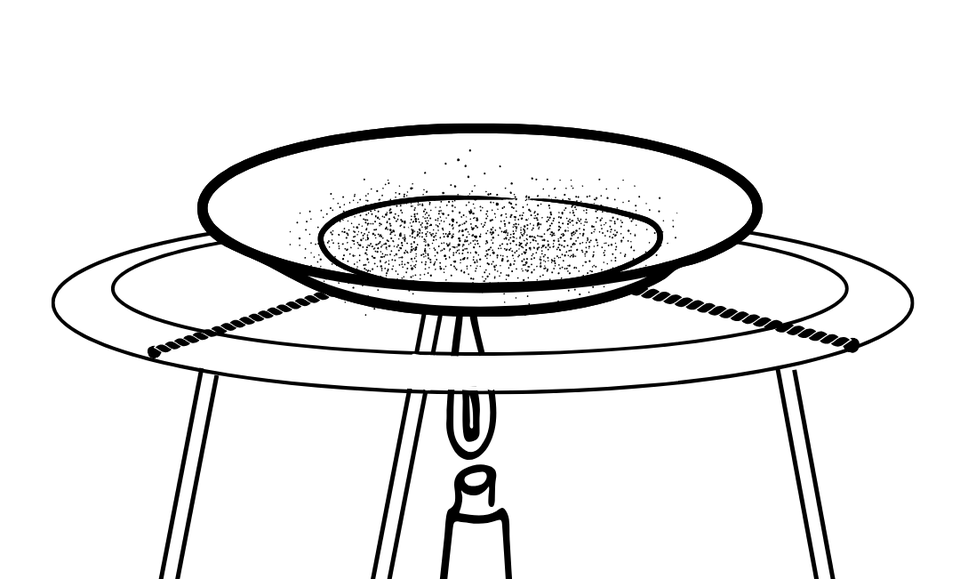
図のような装置で、赤かっ色の銅の粉末を加熱する実験を行うと、銅の粉末は酸化して、黒っぽい酸化銅が生成されます。(実験中、銅を空気中の酸素と良く反応させるため、銅の粉末をうすく広げながらよくかき混ぜる必要があります。)
銅の酸化を化学反応式で表すと次のようになります。
2Cu + O₂ → 2CuO
銅 + 酸素 → 酸化銅
化学反応式としてはFeがCuに変わっただけなので、数字の付け方は先ほどと同じです。
酸化の中でも、光や熱を出しながら激しく反応するものを燃焼といいます。冒頭で紹介した錆(さび)はゆっくりな酸化のことでしたよね。
ここではマグネシウム、有機物、水素の燃焼について解説します。
マグネシウムの燃焼を化学反応式で表すと次のようになります。
2Mg + O₂ → 2MgO
マグネシウム + 酸素 → 酸化マグネシウム
これも
2Fe + O₂ → 2FeO
2Cu + O₂ → 2CuO
の赤字部分がMgに変わっているだけです。詳細は酸化鉄の図を参考にしてください。
そもそも、有機物とは何なのでしょうか。
有機物とは、炭素を含む物質のことです。反対に、炭素を含まない物質を無機物といいます。
有機物の特徴は、燃焼すると水と二酸化炭素が生成されることです。
有機物の燃焼の例として、メタン(CH₄)という有機物の燃焼を化学反応式で表したものを紹介します。
CH₄+ 2O₂→ CO₂ + 2H₂O
水(H₂O)が生成したことから、有機物には 水素(H) 原子が含まれていることが、二酸化炭素(CO₂)が生成したことから、有機物には 炭素(C) 原子が含まれていることがわかります。
水素の燃焼を化学反応式で表すと次のようになります。
2H₂ + O₂ → 2H₂O
水素 + 酸素 → 水
\小・中・高校生の勉強にお悩みのある方へ/

ここまで学んできた酸化は、物質と酸素が結びつく化学変化のことでしたね。これから紹介する還元は、一言でいえば酸化の逆の化学変化です。つまり、酸素と結びついた物質(酸化物)から酸素を取り去る化学変化のことを指します。
どういうことか、詳しく見ていきましょう。
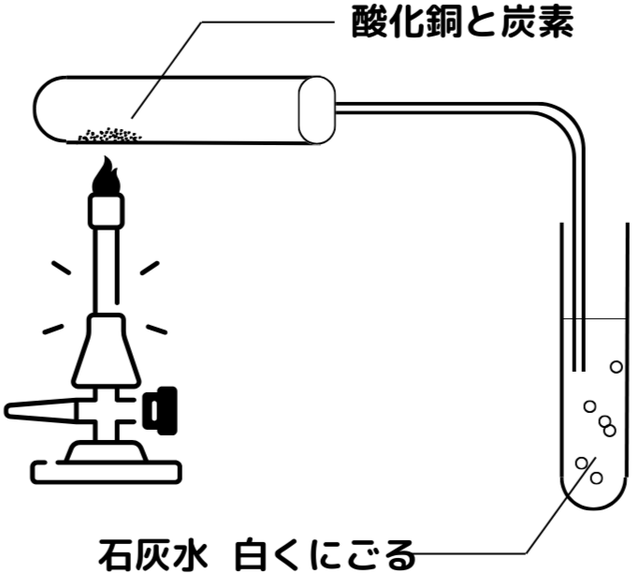
図は酸化銅と炭素の混合物を加熱することで還元を行うという実験です。
この実験では以下の化学変化が起こります。
酸化銅 + 炭素 → 銅 + 二酸化炭素
2CuO + C → 2Cu + CO₂
酸化銅と混ざっていた炭素が、加熱されることで酸化銅に含まれる酸素と結合し、二酸化炭素となって石灰水のあるビーカーに流れ込んだということです。
つまり、酸化銅は酸素を炭素に奪われたということです。言い換えれば、炭素は酸化銅の酸素を使って酸化したということになります。

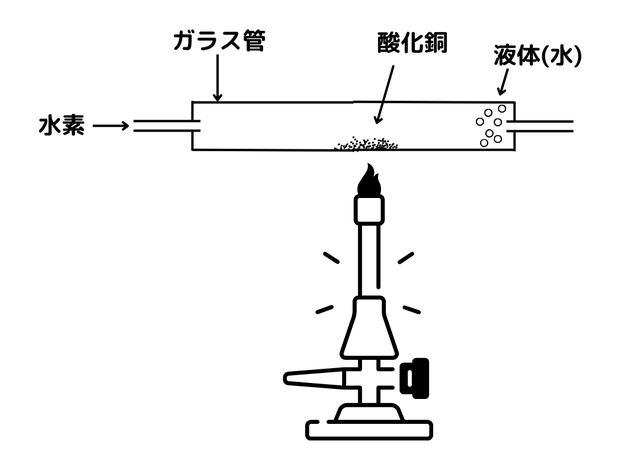
図は水素の入ったガラス管の中で、酸化銅と加熱することで還元を行うという実験です。
この実験では以下の化学変化が起こります。
酸化銅 + 水素 → 銅 + 水
CuO + H₂ → Cu + H₂O
つまり、酸化銅は酸素をうばわれて銅になる還元が起こり、水素は酸化銅から酸素をうばい、水になる酸化が起きたということです。
これまでの内容で、鉄と銅は酸素と結びつくことが分かりました。では、酸素以外の物質はどうでしょうか。
ここでは、鉄、銅と硫黄の化学反応についてご紹介します。
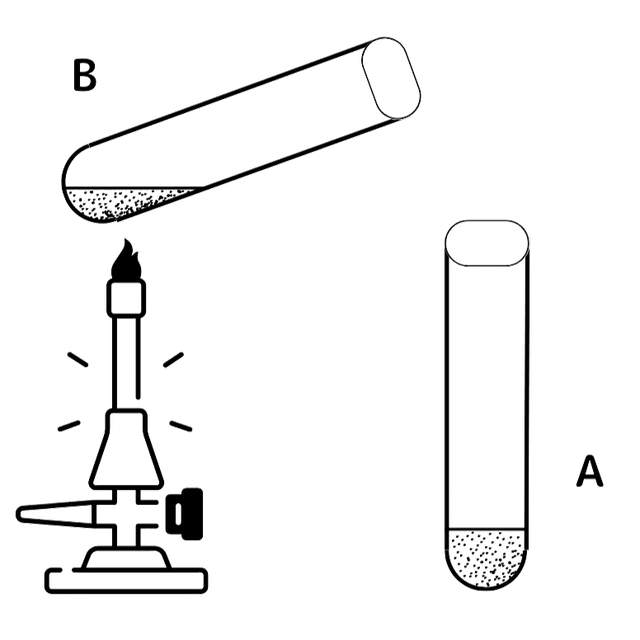
鉄と硫黄の混合物が入った2つの試験管A・Bを用意し、AはそのままでBは加熱をしました。するとBの試験管で化学変化が起こりました。Bで起きた化学変化は加熱をやめても起こり続けました。反応後の物質は、磁石にくっつかない、塩酸を加えるとにおいのある気体が発生する、という特徴がありました。
この実験で起きた化学変化は以下の通りです。
鉄 + 硫黄 → 硫化鉄
Fe + S → FeS
Bの試験管で加熱をやめても反応が起こったのは、硫化鉄が出来る時に熱が発生し、その熱によって反応が起こったからです。また、塩酸を加えた時に発生した気体は硫化水素です。硫化鉄は 酸には硫化水素を放って溶けるという性質があります。
銅と硫黄の反応も、鉄と硫黄の実験と同様に、鉄を銅に変えて行います。この実験では以下の化学反応が起こります。
銅 + 硫黄 → 硫化銅
Cu + S → CuS
どちらの化学変化も、H₂やO₂のようにもともと2以上の原子がくっついてできている物質がないので、化学変化の前後で数字の帳尻を合わせる必要はありません。
最後までお読みいただきありがとうございました。
今回は酸化、燃焼、還元、硫黄の反応について紹介しました。他にも理科の定期テスト対策の記事があるのでチェックしてみてください!他にも様々なお役立ち情報をご紹介しているので、ぜひご参考にしてください。質問などございましたら、お気軽にお問い合わせください!