こちらのページでは電気分解について解説していきます。
イラストや図を用いてわかりやすく解説していくので授業の予習復習や定期テスト対策にご活用ください!
その他のやる気アシストの勉強記事 (理科編) もこちらから見ることができます。ぜひご覧ください!
電解質・非電解質とは?
水に溶かしたとき水溶液に電流が流れる物質を 電解質 といい、水溶液が電流を流さない物質を 非電解質 といいます。
電解質には食塩(塩化ナトリウム)・塩化水素(塩酸)・水酸化ナトリウム、非電解質には純粋な水・砂糖、ショ糖・エタノールなどがあります。
固体では電気を通さなくても水溶液化すると電気を通すようになるものがあるのが電解質・非電解質の特徴です。

電気分解を行う実験を見ていきます。まずは塩酸の電気分解についてです。
塩酸の電気分解の実験
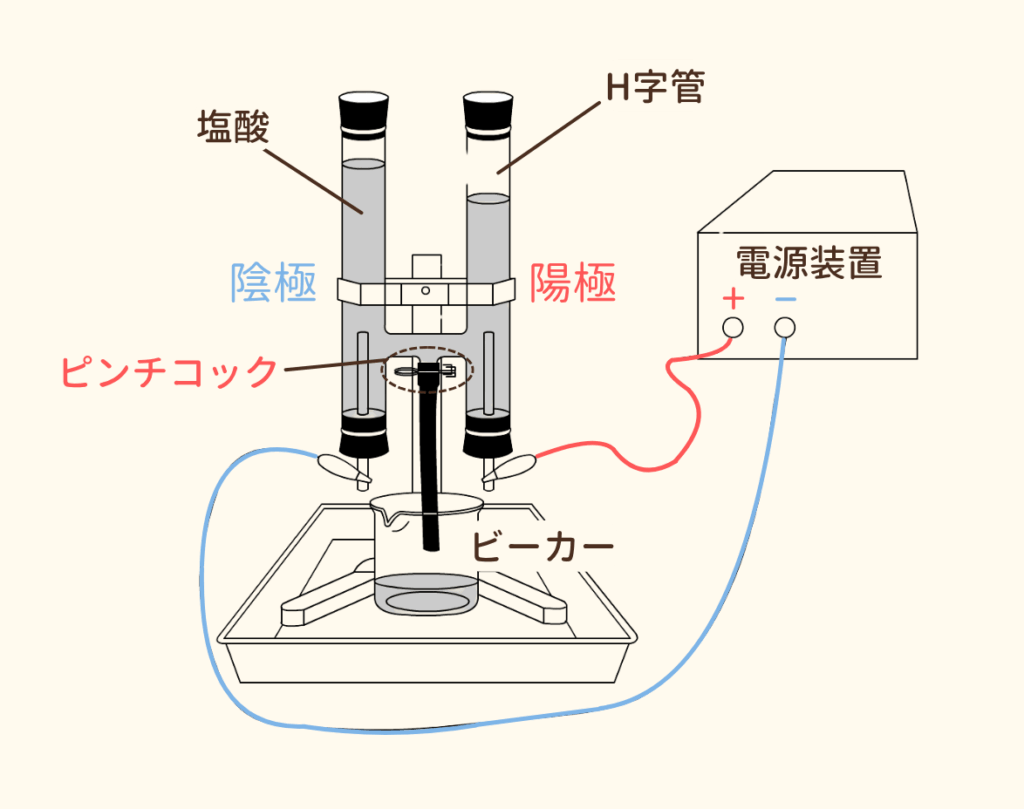
図のような装置で実験を行います。
H字管の中に塩酸を入れて、電気を流します。電源装置の+極につながる電極を陽極、-極につながる電極を陰極といいます。
実験結果
陰極・陽極でそれぞれ異なる気体が発生。
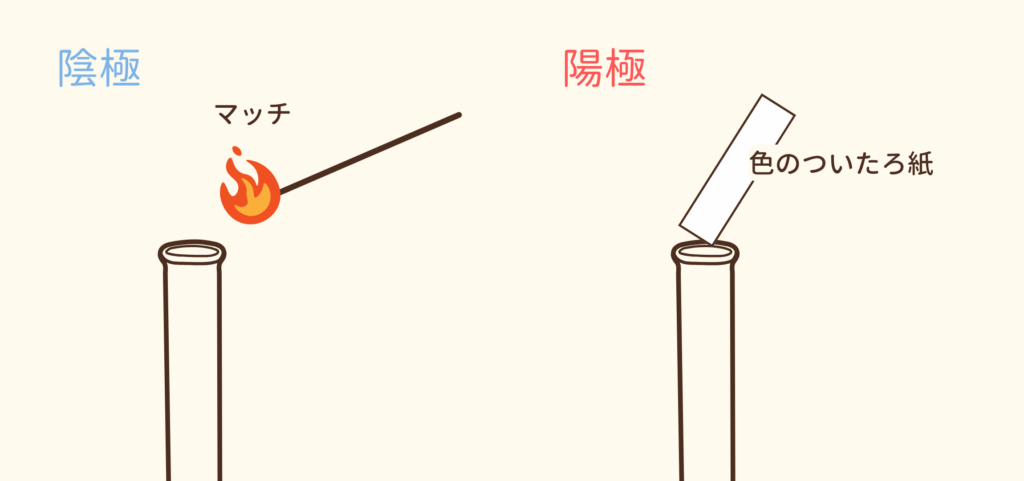
陰極に火のついたマッチを近づけると音を立てて燃えた。
→ 水素が発生
陽極に色をつけたろ紙を近づけると脱色
→ 塩素が発生
実験からわかること
塩化水素に電気を流すと水素と塩素に分かれる。この反応を化学反応式で表すと次のようになる。

次に塩化銅水溶液の電気分解について見ていきます。
塩化銅水溶液の電気分解の実験
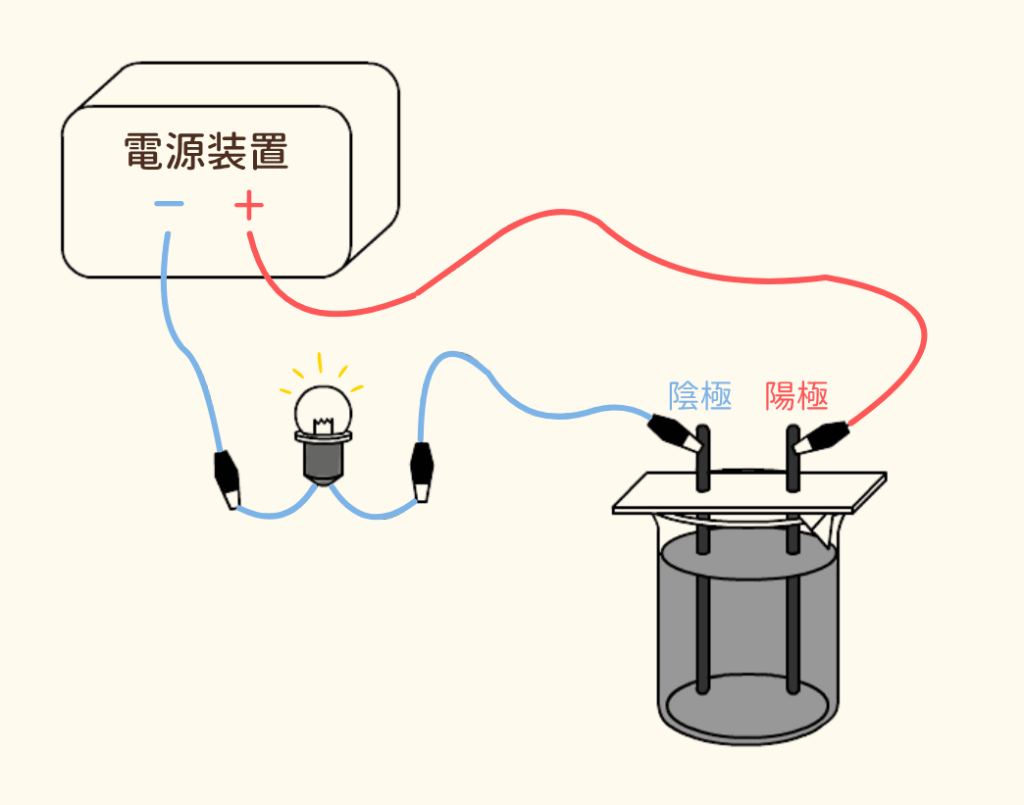
図のような装置で実験を行います。
ビーカーの中に塩化銅水溶液を入れて、2本の炭素電極を指します。
→電源装置と豆電球をつなぎ回路を作り、電気が流れるかを確かめます。
実験結果
豆電球は点灯し、陰極と陽極のそれぞれ電極で、異なる反応が起きた。
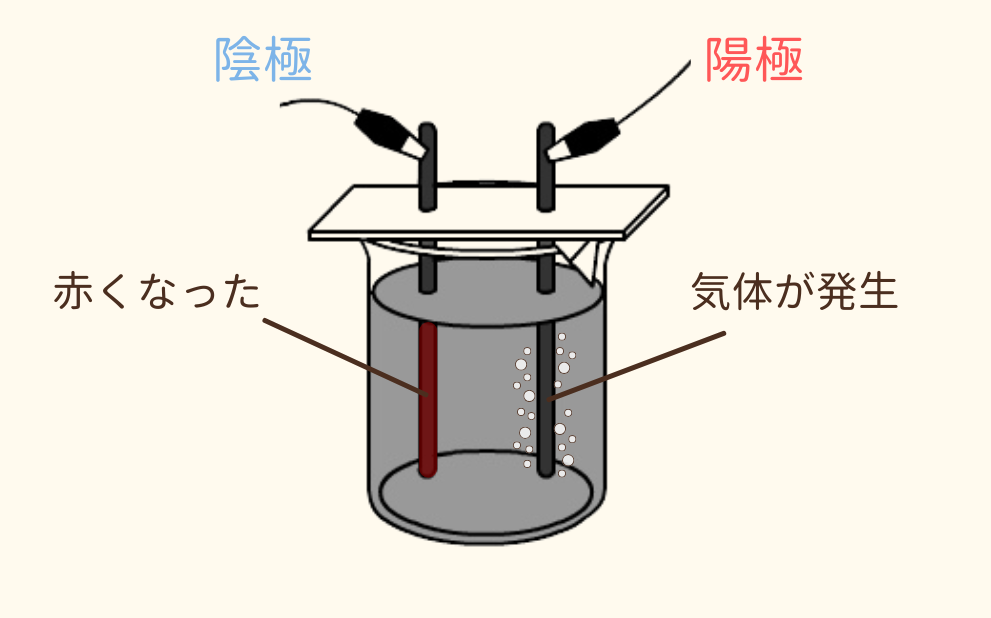
陰極は赤くなった電極をこすると光沢が出たため金属であると分かった。
→赤色の金属=銅
陽極は集めた気体に赤色ろ紙を近づけると白くなった。
→塩素が発生
実験からわかること
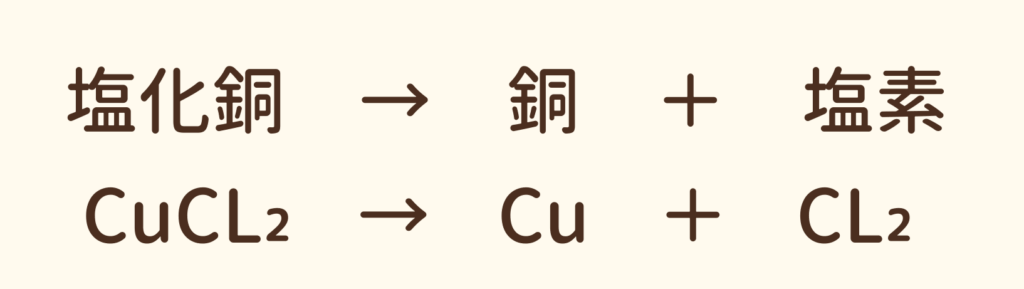
塩化銅水溶液に電気を流すと銅と塩素に分かれる。この反応を化学反応式で表すと次のようになる。
\小・中・高校生の勉強にお悩みのある方へ/

電解質の水溶液を電気分解したとき、陽極にはマイナスの電気をもった粒子、陰極にはプラスの電気をもった粒子がそれぞれひきつけられます。
塩化銅水溶液の実験で確認しましょう。
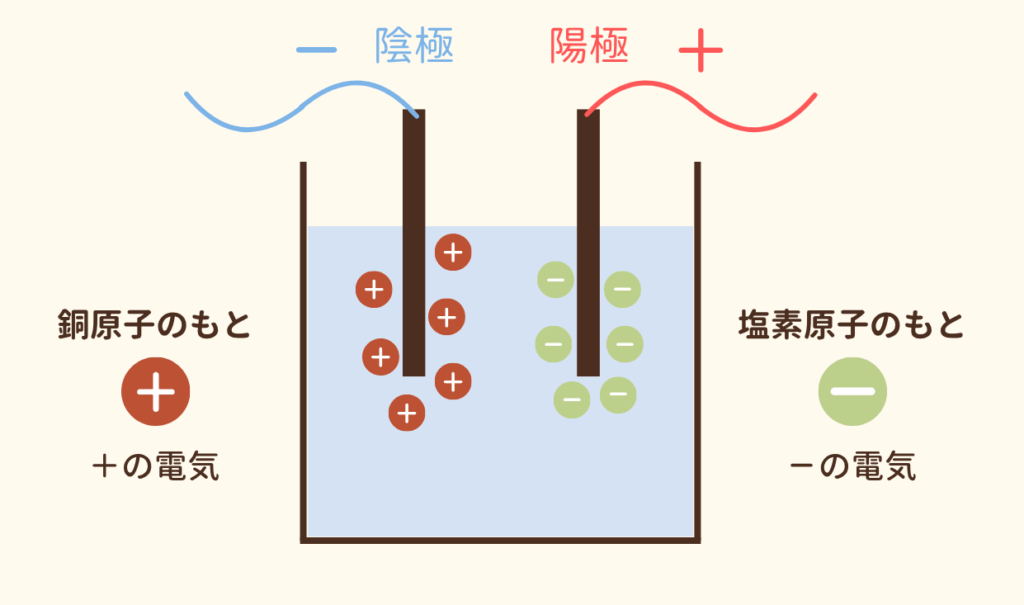
銅原子のもとは+の電気を持っています。対して、塩素原子のもとは-の電気を持っています。
+の銅原子は電池の-極とつながった陰極に近づき、-の塩素原子は電池の+極とつながった陽極に近づきました。
塩化銅水溶液に電気が流れたのは、このように+の電気を持つ粒子と-の電気を持つ粒子がそれぞれ異なる電極に移動し、結びついたからです。
また、電解質の水溶液の中では+と-の電気を帯びた粒子があるということがわかります。
最後までお読みいただきありがとうございました。
今回は電気分解について紹介しました。その他の理科の定期テスト対策の記事はこちらからチェックしてみてください!
他にも様々なお役立ち情報をご紹介しているので、ぜひご参考にしてください。質問などございましたら、お気軽にお問い合わせください!